人才招聘
JOBS
“心怀梦想,走近Nature”系列三——困扰已久的细胞自发荧光总算有了科学的解答!
8月刚在Nature Scientific Report 上发表了一篇题为《Strong increase in the autofluorescence of cells signals struggle for survival》的文章,深入研究了细胞自发荧光,让人对自发荧光有了比较全面的了解。被自发荧光困扰已久的小伙伴们来读一读这篇文章吧。
摘要:
由于荧光细胞结构组分和代谢物的存在,原核和真核细胞表现出固有的自发荧光。因此,作者预期细胞自发荧光(AF)随细胞的代谢状态而变化,研究了不同应激源的暴露如何改变大肠杆菌细胞的AF。他们观察到杀菌处理增加了绿色AF,并且观察到的AF增加需要从头蛋白质合成。激发和发射光谱以及来自黄素生物合成途径的基因表达的增加强烈暗示黄素是增加AF的主要贡献者。编码参与能量产生和ROS解毒的各种黄素蛋白的基因表达增加,表明这是一种应对严重应激的细胞策略。在应激下观察到的AF增加是一种进化保守现象,因为它不仅发生在来自不同细菌物种的细胞中,而且也发生在酵母和人类细胞中。
前言:
所有原核和真核细胞都表现出内在的自发荧光,因为存在不同的荧光细胞结构成分和代谢物,如黄素,烟酰胺 - 腺嘌呤二核苷酸,芳香族氨基酸,脂质过氧化物,晚期糖基化终产物和胶原蛋白。细胞AF光谱包含大部分光谱范围。例如,当在适当波长下激发时,黄素,NAD和脂褐素分别发出绿光,蓝光和橙光。由于这个原因,AF经常与用于研究目的的外源荧光团的光谱重叠,因此干扰荧光分析,这种现象被称为背景荧光,噪声或光谱串扰。
然而,细胞AF本身具有几个优点可用于各种分析。首先,可以监测细胞AF,而不需要涉及外部荧光团,避免了样品和使用者的潜在化学毒性,以及非特异性结合和对生物分子功能的干扰。其次,可以原位检查AF而不破坏细菌生物膜和多细胞真核组织等复杂结构。第三,由于细胞AF随细胞形态以及细胞的代谢和病理状态而变化,因此可用于诊断目的。例如,组织AF的变化用于非侵入性体内肿瘤的检测。通过测量HeLa细胞的AF变化来监测肠出血性大肠杆菌对人HeLa细胞的感染。 AF也被用作秀丽隐杆线虫线虫衰老的可靠生物标志物。 AF还可用于快速检测和鉴定食品中的细菌污染物,因为不同的细菌菌株和物种具有不同的固有荧光。
在这项研究中,作者研究了大肠杆菌细胞的AF如何随着暴露于不同应激物而发生变化。作为压力源,使用的抗生素除了具有医学重要性外,还是解决细菌生理学复杂性的强大工具。作者使用了两类抗生素:β-内酰胺类细胞壁合成抑制剂,蛋白质合成抑制剂四环素和庆大霉素。他们发现用β-内酰胺抗生素氨苄青霉素或次氯酸钠处理大肠杆菌显着增加细胞AF,而在蛋白质合成抑制剂处理的细胞中没有观察到显着的AF增加。数据表明,黄素是杀菌治疗诱发房颤的主要原因,而AF增加显示细胞适应性反应,以应对生命威胁压力源。最后作者证明了经过生命威胁治疗的绿色细胞AF的增加是一种进化保守现象,因为它不仅发生在来自不同细菌物种的细胞中,而且也发生在酵母和人类细胞中。
在研究过程中作者多次用到了Bio-Rad S3e流式细胞分选,先后完成了分选工作、自发荧光检测及细胞活性实验,充分体现了S3e分选和分析的能力。

取得结果如下
1.氨苄西林诱导的自发荧光增加。
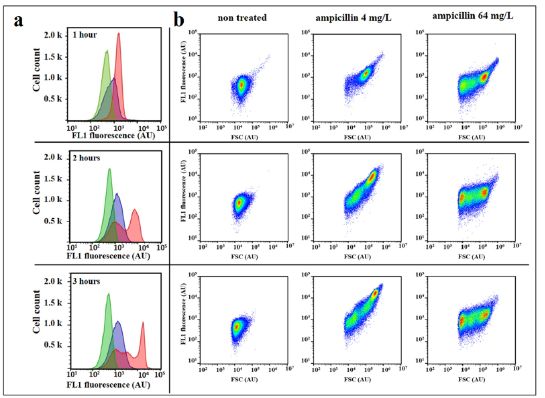
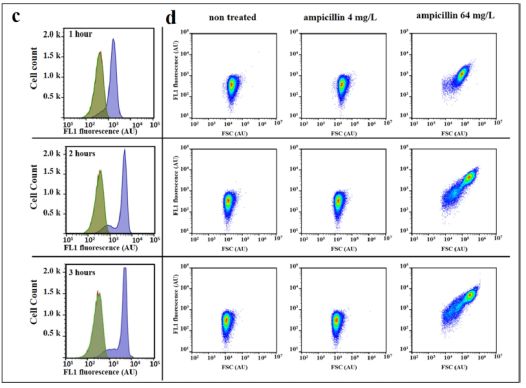
图1.氨苄青霉素处理对大肠杆菌细胞的前向光散射和自发荧光强度的影响。大肠杆菌7705035[MIC=4mg/L;(a)和(b)]和8812112[MIC=64mg/L;(c)和(d)]用一系列氨苄青霉素浓度处理细胞3小时的指数生长。在1,2和3小时后测量处理细胞和未处理对照的自发荧光和前向光散射信号(FSC)。
2.蛋白质合成是自发荧光增加的先决条件。
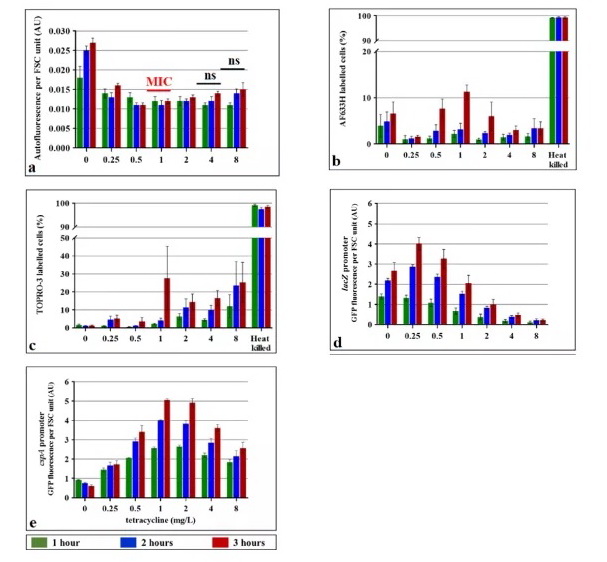
图2.四环素处理对大肠杆菌细胞自发荧光,蛋白质合成和活力的影响。用一系列四环素浓度处理大肠杆菌7705035细胞3小时的指数生长。该菌株的MIC为1mg / L的四环素。使用AF633H(b)和TOPRO-3(c)染料和流式细胞仪评估自发荧光(a)和细胞活力。作为死细胞染色的对照,通过在65℃温育30分钟来杀死细胞。使用lacZ(d)和cspA(e)启动子评估四环素对蛋白质合成的影响,所述启动子与编码快速折叠绿色荧光蛋白(GFP)的基因融合。已知cspA由蛋白质合成抑制抗生素诱导,而lacZ应被抑制。携带具有这些报告基因融合体的质粒的指数生长的大肠杆菌细胞以及无启动子的对照质粒与IPTG和一系列四环素浓度一起温育3小时。通过减去无启动子的自发荧光去除背景自发荧光。用流式细胞仪监测每个细胞的GFP荧光和FSC,并通过FSC标准化细胞自发荧光或GFP荧光。值表示三次独立实验的中值的平均值(+/-标准误差)。
3.黄素是自发荧光增加的主要原因。
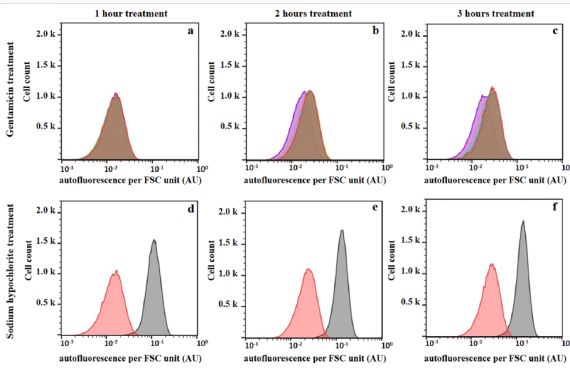
图3. 庆大霉素和次氯酸钠处理对大肠杆菌细胞自发荧光的影响。 大肠杆菌7705035细胞用一系列庆大霉素浓度处理,对应于0(红色),0.125(浅蓝色),0.25(橙色),0.5(MIC;浅绿色),1(深绿色),2(棕色)和 4mg / L(紫色)或0.08%次氯酸钠(灰色)指数生长3小时。 使用流式细胞仪在孵育1,2和3小时后测量处理细胞和未处理对照的自发荧光和FSC。 通过FSC信号标准化细胞自发荧光以获得每FSC单位的自发荧光。 (a),(b)和(c)分别为庆大霉素治疗1,2和3小时。 红色,浅蓝色,橙色,浅绿色和深绿色的重叠产生棕色区域。 (d),(e)和(f)分别为次氯酸钠处理1,2和3小时。 该图显示了代表性实验的结果,其独立重复4次。
4.在氨苄青霉素处理的细胞中保护诱导编码黄素蛋白的基因。
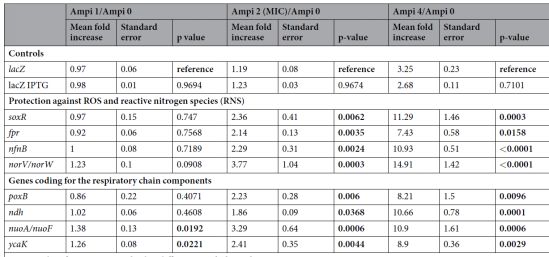
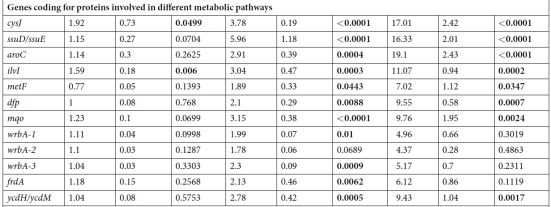
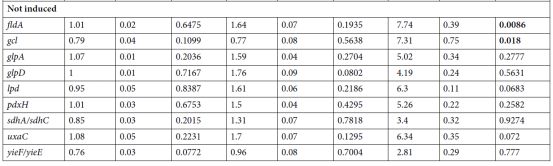
表1.在氨苄青霉素处理的大肠杆菌细胞中编码黄素蛋白,soxR和lacZ基因的28种基因的表达。 将测试基因的启动子与编码快速折叠绿色荧光蛋白的基因融合(GFP;λex488/ 9 /λem525/ 20nm)。 携带具有这些转录报道融合体的质粒的大肠杆菌MG1655菌株(MIC氨苄青霉素= 2mg / L)以一系列氨苄青霉素浓度生长。 孵育3小时后,使用荧光计测量处理细胞和未处理对照的GFP荧光(λex488/ 9 /λem525/ 20nm)和OD600nm。 通过OD600nm标准化荧光。 每个值代表与来自六个独立实验的每个菌株的未处理条件相比的荧光增加的平均值(+/-标准误差)。 根据单向ANOVA Dunn检验<0.05的lacZ对照的显着差异以粗体显示。
讨论:
在这项研究中研究了大肠杆菌细胞的AF如何随着暴露于不同应激物而发生变化。作者发现杀菌应激物如β-内酰胺氨苄青霉素,可显着增加细胞AF,并且AF的增加需要从头合成蛋白质。几个证据表明AF中观察到的大部分增加来自黄素。首先,氨苄青霉素处理的细胞的AF的激发和发射光谱对应于纯化的黄素的光谱:核黄素,FMN和FAD。其次,用氨苄青霉素处理诱导FMN和FAD生物合成所需的ribA,ribB,ribC和ribE基因。第三,氨苄青霉素处理的细胞具有缺失yeeO基因,其编码输出FMN和FAD的MATE转运蛋白,具有比具有功能性yeeO的氨苄青霉素处理的细胞更高的AF增加。第四,许多编码黄素蛋白的测试基因在过表达氨苄青霉素处理的细胞。
作者还证明,增加的AF不仅仅是细胞毒性的附带结果,而且是对复杂环境的适应性反应的激活。通过以下事实说明:强氨苄青霉素处理的细胞的平板的AF平均比低氨苄青霉素处理的细胞高5倍。观察到的氨苄青霉素诱导基因的细胞功能表明黄素产生增加有助于增加细胞稳健性。重要的是,当杀菌应激物的浓度接近或高于MIC时,相对于未处理的对照,AF显着增加。因此,AF可用于评估细菌病原体对杀菌,非蛋白质合成抑制抗生素的敏感性。
总之,本研究表明AF增加表明原核和真核细胞正在经历严重的危及生命的压力。 观察到的AF增加可能来自氧化和合成黄素。 氧化和/或黄素新合成对AF增加的相对贡献可能由应激物的性质和强度决定。 因此,通常测量AF变异,尤其是黄素和黄素蛋白的变异,可用于研究细胞代谢状态和应激反应中涉及的分子机制,但也可用于原核和真核细胞中的各种诊断应用。
本产品仅限科研使用,不作为临床诊断。
Bio-Rad 是 Bio-Rad Laboratories, Inc. 在特定区域的商标。

电话:021-61283010
网址:www.bio-chain.com
邮箱:marketing@bio-chain.com
地址:上海市徐汇区虹漕路421号65幢303室
上海柏辰生物科技有限公司 版权所有 严禁复制 网站备案号:沪ICP备09099502号-1 沪公网安备 31010402002899号 网站建设:铭心科技



